



(一)基本概况
临床医学研究中心下设药物临床试验机构办公室、医学伦理委员会办公室和药物I期临床试验研究病房。中心现有专职工作人员13人,包括研究医生、药师、护士等,所有人员均接受GCP相关培训和专业技术培训,3人为国家药监局核查中心检查员,其中1人担任检查组长。为中国药理学会药物临床试验专业委员青委会主任委员单位和江西省药物临床试验与研究学会副理事长单位。为“十三五”国家科技部“重大新药创制”GCP平台子课题负责单位。
江西省肿瘤医院国家药物临床试验机构于2013年5月首次通过国家药监局药物临床试验机构资格认定,于2017年5月通过机构资格认定复核检查。2018年完成医疗器械临床试验机构管理信息系统备案,目前有医学检验、医学影像、病理、麻醉、外科等13个医疗器械临床试验专业。2020年完成药物临床试验机构管理信息系统备案,目前有肿瘤、血液、骨科、中医肿瘤、放射治疗、核医学、妇科和I期8个药物临床试验专业。近五年,承担临床试验项目300余项,接受并顺利通过国家药监局现场核查3次。
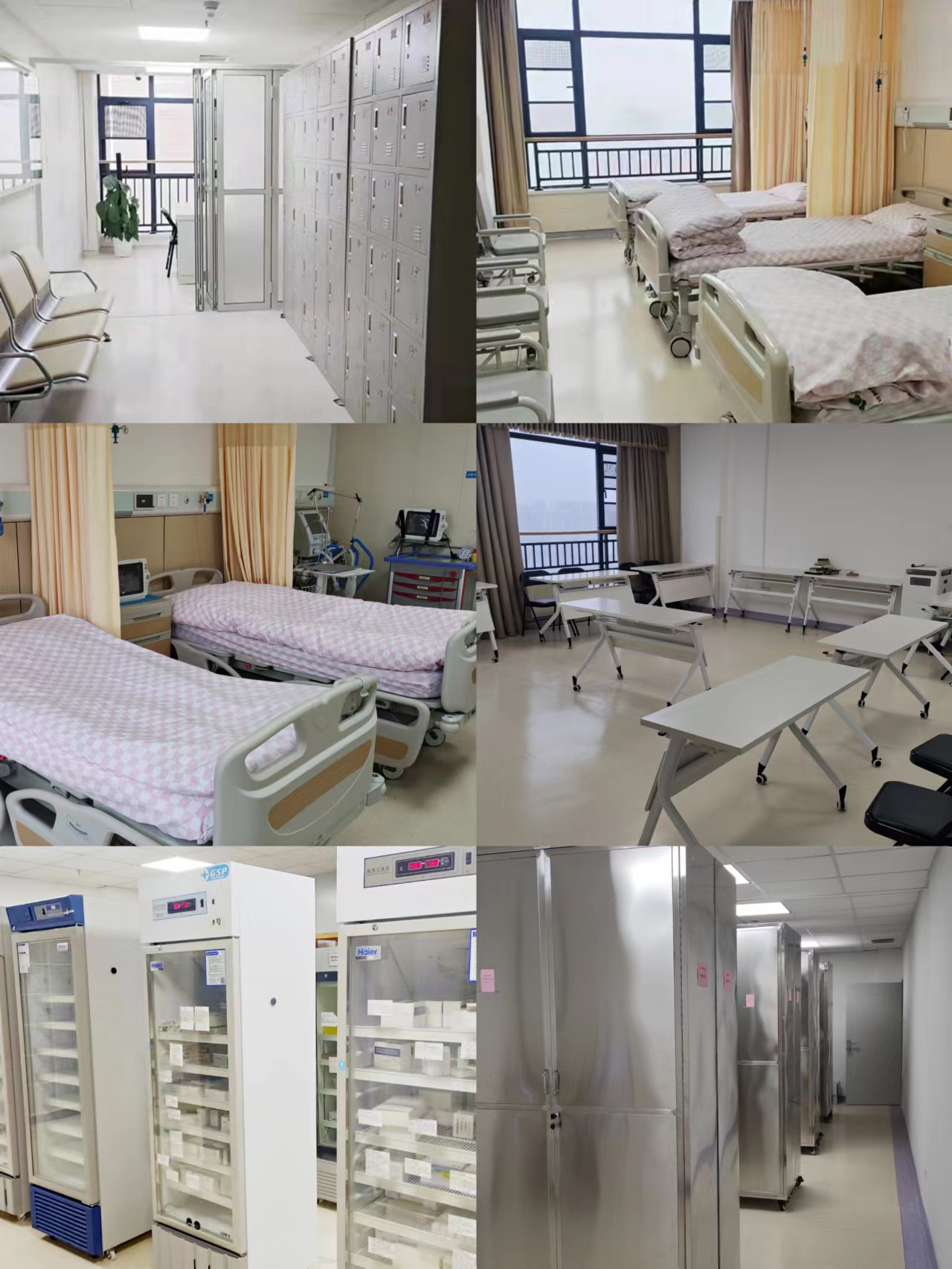
药物I期临床试验研究病房占地1800余平方米,病房配制有13间病房,1间重症监护室,编制床位数共41张,科室现配有2名专职医生,4名专职临床护士,均完成国家GCP培训并取得证书。
(二)管理框架
临床医学研究中心负责人:张红,0791-88331329
药物临床试验机构办公室负责人:曾彩雯,0791-88330172
药物I期临床试验研究病房负责人:张红、王晓松,0791-88289673
医学伦理委员会秘书:陈小丹,0791-88330236

(三)中心宗旨
激励研究者做好临床研究、促进创新研究与转化、培养提升临床研究人才、“医联体+临床研究”模式创立、创建标准的研究型医院等,并为该宗旨提供全方位、精细化的管理服务。

(四)服务范围
1.新药I期临床试验,包括新药的首次人体试验(FIH)、临床药代动力学(PK)、药物相互作用(DDI)、特殊人群PK研究等;
2.人体生物等效性试验,包括人体生物利用度和仿制药一致性评价;
3.定量药理学研究,包括群体药代动力学(PPK)、群体药代动力学(PPD)、药物体内外相关性(IVIVC)、生理药代动力学(PBPK)研究等;
4.药物基因组学研究;
5.临床试验项目的运行管理,包括各期药物临床试验、医疗器械临床试验及研究者发起临床研究;
6.临床试验项目的伦理审查。

(五)服务地址
江西省南昌市北京东路519号,住院部大楼23楼东,临床医学研究中心
Copyright @ 2010-2019 江西省肿瘤医院版权所有
