![]()
![]() 江西省肿瘤医院
江西省肿瘤医院
新技术、新项目准入管理制度
(2022年修订)
为进一步优化我院新技术、新项目的申报和审批流程,根据国家卫健委《医疗技术临床应用管理办法》(国家卫生健康委令第1号)、原国家卫计委《关于取消第三类医疗技术临床应用准入审批有关工作的通知》(国卫医发〔2015〕71号)精神,结合我院实际,制定本制度。
一、本制度所指的新技术、新项目是指我院范围内首次应用于临床诊断(含检查、检验项目)和治疗技术,包括医学界尚未实施或已成熟但在本院尚未开展的诊疗技术。
二、拟开展的技术项目必须符合国家相关法律法规和规章制度,同时应具有科学性、先进性、安全性,符合医学伦理规范。
三、申报新技术前,科主任或项目负责人需组织相关人员做好以下准备工作:
1、论证项目国内外开展情况、安全性、先进性、经济性;
2、分析项目存在的风险和影响,并制定相应预案;
3、评估开展新技术的技术和设备等条件;
4、详细拟定新技术的技术规范、操作规程;
5、根据医疗技术操作规范明确新技术第一操作者最低职称限定标准及相关人员职责。
四、申报新技术须提交的材料:
1、《江西省肿瘤医院新技术、新项目审批申请表》。
2、新技术的技术规范、操作规程。
3、新技术小组成员的职务、职称、科室、专业、相关研究业绩、分工、职责、联系电话等。
五、新技术申报审批流程:
1、申报科室填写《江西省肿瘤医院新技术、新项目审批申请表》,备齐相关材料后报医务科备案审批。
2、对于无创技术或项目、医疗风险较小、本省其它医院已广泛应用并具有较好疗效和效益,并已有相应的收费标准者,由医务科根据新技术专业的关联性委托医疗技术管理委员会3-5名专家填写《新技术和新项目专家评审意见表》,各专家全部同意后即可开展实施。如有专家不同意开展,则提交医疗技术管理委员会进行讨论。
3、对于有创技术或项目;医疗风险较大、易致死致残,存在一定安全隐患;疗效及效益尚不明朗;或存在其他特殊情况者,由医务科组织召开医疗技术管理委员会进行审批,会上由申请人对项目的先进性、科学性、安全性、实用性、社会效益等进行解读,委员对是否同意新项目开展进行投票表决,超过到会委员人数半数为通过审核。
4、对于各科室提出的新技术新项目的准入申请,无论批准与否,医务科均予以书面答复,说明理由或注意事项。
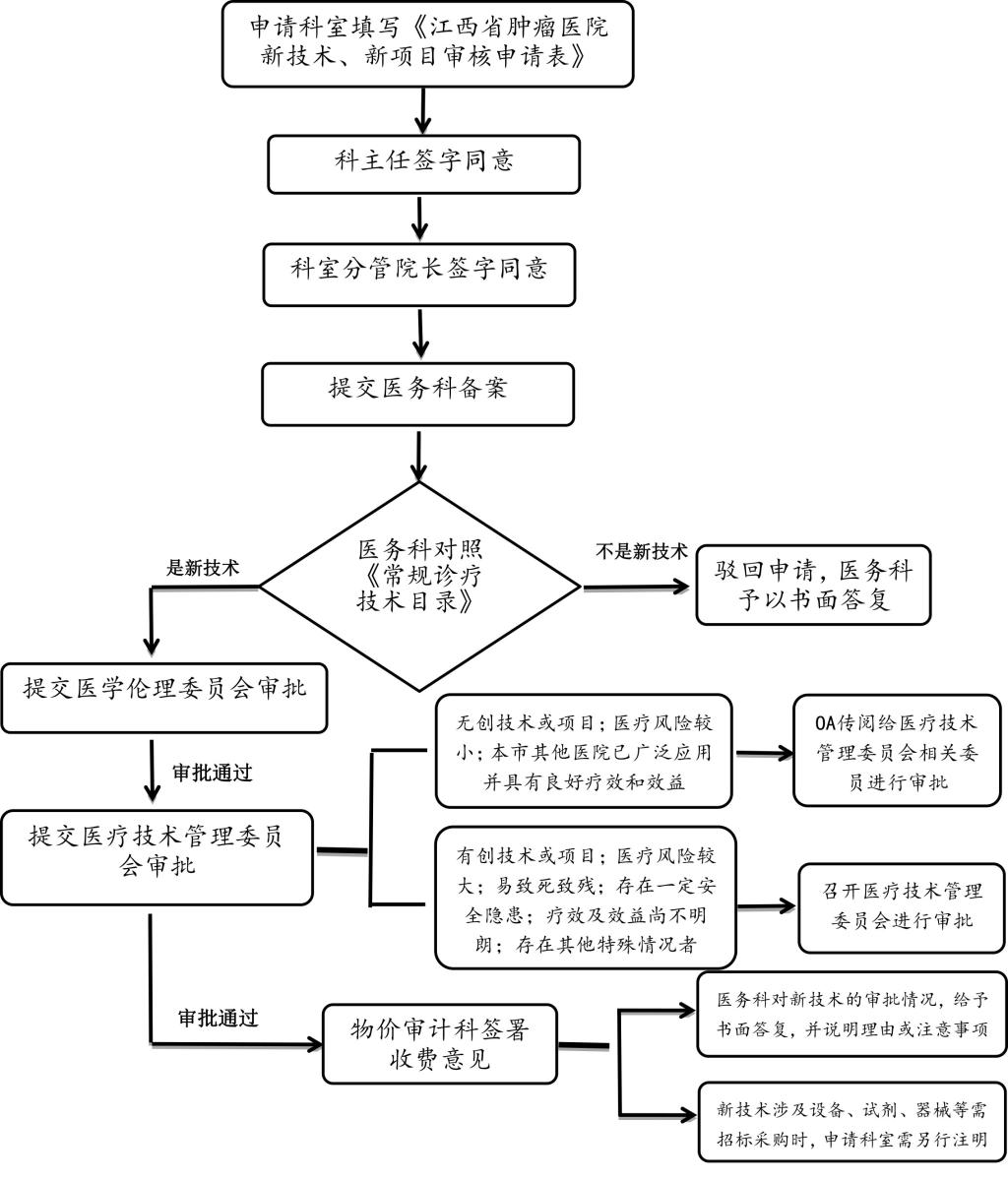
图1 新技术申报审批流程图
六、医院新技术试用期、报告制度及转化为常规技术程序:
1、试用期:新技术的临床试用期均为1年。
2、报告制度:科室需对项目的进展情况进行登记,新技术和新项目批准实施满6个月后向医务科递交《江西省肿瘤医院新技术和新项目半年反馈表》。科室在开展新技术和新项目过程中所遇各种问题,均应及时向医务科汇报。
3、转化为常规技术程序:试用期满后,由开展科室填写《江西省肿瘤医院新技术和新项目转常规技术审批表》提交医务科审核,然后由医疗技术管理委员会审批,审批通过后即可转为常规技术。此后将按照常规技术进行管理,待常规诊疗技术目录更新时将该技术列入目录。
七、临床应用管理要求:
1、医疗技术管理委员会负责新技术新项目的临床应用准入管理工作,医学伦理委员会负责新技术新项目的伦理审查工作。
2、新技术新项目经医疗技术管理委员会和医学伦理委员会审批通过后方可进行收费和招标采购。绩效物价核算办负责新技术新项目收费标准的管理及项目效益审计,器械科负责新技术涉及设备、试剂、器械的招标和采购工作。
3、医疗技术管理委员会办公室设在医务科,医务科负责全院新技术和新项目的日常管理工作,建立医院新技术和新项目管理档案,并组织医疗技术管理委员会对全院开展的新技术和新项目进行不定期督查及重点抽查。
4、科室必须严格按照操作规范实施新技术、新项目,应充分尊重患者的知情权和选择权,并注意保护患者安全,如在新技术临床应用过程中发生不良事件,需按照《江西省肿瘤医院医疗风险及损害处置预案》进行处理,并及时上报医务科。
5、严禁未经审核自行开展新技术和新项目,否则,将视作违规操作,并在院周会进行通报,由此而引起的医疗或医学伦理上的缺陷、纠纷、事故,将由当事科室或个人承担。
本制度自发布之日起生效,原《新技术、新项目准入管理制度》同时废止。
附件1:江西省肿瘤医院新技术、新项目审批申请表
附件2:江西省肿瘤医院新技术、新项目专家评审意见表
附件3:江西省肿瘤医院新技术、新项目半年反馈表
附件4:江西省肿瘤医院医疗新技术、新项目转常规技术审批表
附件1
江西省肿瘤医院
新技术、新项目审批申请表
项目类型: £手术类 □介入类 □治疗操作类
□检验检查类 □其他类
项目名称:
负 责 人:
申 报 人:
申请科室:
申请时间: 年 月 日
一 、申请科室相关学科基本情况
(一)项目负责人基本情况 |
||||||||||
姓 名 |
|
性别 |
|
出生年月 |
|
|||||
毕业学校 |
|
|||||||||
最高学历 |
|
专 业 |
|
|||||||
职 称 |
|
获得职称时间 |
|
|||||||
1、何时何地开始从事本项目专业工作
2、本项目专业培训(进修)情况
|
||||||||||
(二)参加人员基本情况 |
||||||||||
姓名 |
性别 |
年龄 |
职称 |
学习进修情况 |
||||||
|
|
|
|
|
||||||
|
|
|
|
|
||||||
|
|
|
|
|
||||||
(三)项目开展所需设施、设备和仪器、试剂的三证是否齐全等情况 |
||||||||||
1、技术操作规范、制度及相关流程
2、设施、设备和仪器、试剂的三证齐全 |
||||||||||
二、开展项目的基本情况
(一)项目现状(国内外开展情况、应用现状):
|
(二)目的及意义(医疗需求、社会效益和经济效益等方面): 1、项目临床意义
2、社会效益
3、经济效益
(三)实施方法(具体安排及步骤、适应症、禁忌症、可能发生的并发症及处理对策)
(四)可预见的风险评估及保障患者的安全措施和应急处置预案
|
三、审批意见
科室审核意见:
科主任签字: 年 月 日 |
科室分管院领导意见:
签 字: 年 月 日 |
医疗技术管理委员会意见:
签 章 : 年 月 日 |
医学伦理委员会意见:
签 章: 年 月 日 |
收费标准及依据:
签 字: 年 月 日 |
附件2
医疗技术管理委员会专家评审意见表
项目名称: |
|
项目类型 |
□ 新技术和新项目审批 □ 新技术和新项目转常规 |
评审意见: |
|
是否提交上会讨论: □是 □否 |
|
是否同意直接通过: □是 □否 |
|
专家签名: 年 月 日 |
|
请于 月 日前交医务科
附件3
江西省肿瘤医院
医疗新技术、新项目开展情况半年反馈表
项目名称 |
|
||
项目类型 |
□手术类 □介入类 □治疗操作类 □检验检查类 □其他类 |
||
申报科室 |
|
项目负责人 |
|
准入日期 |
年 月 日 |
通过审核后的 反馈年限 |
□0.5年 □1年 |
□0.5年 □1年 |
|||
开展例数 |
_______例 |
临床应用效果 |
□好 □良好 □差 |
社会效益 |
□好 □良好 □差 |
经济效益 |
□好 □良好 □差 |
适应症掌握情况 |
□好 □良好 □差 |
禁忌症掌握情况 |
□好 □良好 □差 |
主要不良反应、并发症及应对措施:
项目负责人签名 科主任签名: 日期: 年 月 日 日期: 年 月 日 |
|||
医务科意见:
科长签名 年 月 日 |
|||
附件4
江西省肿瘤医院
医疗新技术、新项目转常规技术审批表
项目名称 |
|
||
项目类型 |
□手术类 □介入类 □治疗操作类 □检验检查类 □其他类 |
||
申报科室 |
|
项目负责人 |
|
项目试用期 |
年 月 日 至 年 月 日 |
||
开展例数 |
____________例 |
临床应用效果 |
□好 □良好 □差 |
项目组意见 |
项目开展情况(含成效、技术成熟程度、经济效益、社会效益转为常规技术理由等):
项目负责人签名: 年 月 日 |
||
专科意见 |
科主任签名: 年 月 日 |
||
医务科意见 |
科长签名: 年 月 日 |
||
医疗技术管理委员会意见 |
主任签名: 年 月 日 |
||